El átomo de carbono posee un total de seis electrones, los que están dispuestos en diferentes orbitales atómicos, como se muestra en el diagrama de energías:
 |
Diagrama Nº1
|
Los alcanos y la hibridación sp3.
Cuando el átomo de carbono va a formar parte de una molécula utilizando su saturación máxima, uno de los electrones del orbital atómico 2s, salta al orbital 2pz que está vacío. Este salto tiene por supuesto un costo en energía, el cual es compensado sobradamente con la energía que es liberada al formar el enlace entre uno de estos nuevos orbitales híbridos sp3 del carbono y el orbital del otro átomo. Por ejemplo C-C o C-H. Así, todos los orbitales del nivel 2 quedan con un electrón cada uno. Y en ese momento al combinarse entre sí, dan origen a cuatro orbitales híbridos.

Diagrama Nº2
Estos 4 orbitales sp3 tienen un electrón cada uno, son equivalentes en
energía y esta es menor que la de los orbitales 2p no hibridizados.

Figura Nº1
Cada átomo de carbono así hibridizado, puede formar cuatro enlaces sigma covalentes con otros cuatro átomos. Para el caso de los alcanos estos cuatro átomos pueden ser del tipo hidrógeno o carbono.
El enlace s(C-H)
Hay un principio fundamental en física que dice que si se combinan n orbitales atómicos de diferentes átomos, se obtiene como resultado n orbitales moleculares. Según este mismo principio, si se combina un orbital sp3 de un carbono y el orbital 1s de un átomo de hidrógeno, aportando cada uno de ellos un electrón, deberán obtenerse dos orbitales moleculares sigma . Uno de ellos es s-enlazante y el otro s*-antienlazante. Vea el diagrama Nº3.
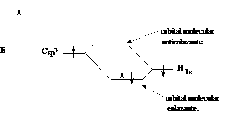
Diagrama Nº3
El enlace s(Ca-Cb)
El enlace sigma entre dos átomos de carbono se forma por combinación de dos orbitales atómicos sp3 híbridos del carbono, con un solo electrón cada uno. Como en el caso anterior esta combinación de dos orbitales atómicos diferentes A y B, produce dos orbitales moleculares. Uno de ellos es sa,b enlazante y el otro s*a,b antienlazante. Los dos electrones aportados por cada átomo van a ocupar el orbital enlazante que es el de menor energía entre los dos orbitales moleculares.

Diagrama Nº4
En ambos casos examinados, los orbitales moleculares s enlazantes (los de menor energía) se forman liberando energía. En general, la formación de un enlace es un proceso exotérmico.
¿Cuales son las características físicas de los enlaces C-C y C-H en los alcanos?
s(C-H):
Energía = ~ 98 - 103 Kcal/mol
Largo = ~1,2 x 10-8 cm.
s(C-C)
Energía= ~83 Kcal/mol
Largo = ~1,54 x 10-8 cm.
Ángulo C-C-C ~109º


No hay comentarios.:
Publicar un comentario